Proteine oder Eiweisse sind aus einer Kette von Aminosäuren (AS) aufgebaut. Es gibt 21 im Menschen vorkommende Aminosäuren.
Molekulare Grundstruktur der Aminosäuren
Die molekulare Grundstruktur der Aminosäuren sieht chemisch wie folgt aus:
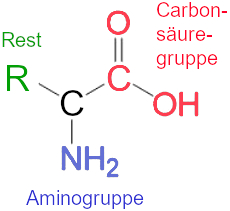
Die Carbonsäuregruppe -COOH ist der Säuregruppe, die Aminogruppe -NH2 ist die Basengruppe. Alle 20 natürlich vorkommenden Aminosäuren haben diese Grundstruktur. Sie alle unterscheiden sich lediglich durch den Rest R. Dieser spezifiziert also die Aminosäure.
Man kann die Aminosäuren nach verschiedenen Kriterien ordnen. Häufig sind die Kriterien Löslichkeit in Wasser (polar und unpolar) und basisch oder sauer. Auch hier ist es der Rest, welcher diese Eigenschaften gibt.
Einige Aminosäuren können mit anderen interagieren.
Liste der natürlich vorkommenden Aminosäuren
| Name | Abk. | essentiell? | Anteil in Proteinen | Eigenschaft |
| Alanin | Ala | nein | 9,0 % | unpolar |
| Arginin | Arg | semi | 4,7 % | basisch |
| Asparagin | Asn | nein | 4,4 % | polar/neutral |
| Asparaginsäure | Asp | nein | 5,5 % | sauer |
| Cystein | Cys | nein | 2,8 % | polar/neutral |
| Glutamin | Gln | nein | 3,9 % | polar/neutral |
| Glutaminsäure | Glu | nein | 6,2 % | sauer |
| Glycin | Gly | nein | 7,5 % | polar/neutral |
| Histidin | His | semi | 2,1 % | basisch |
| Isoleucin | Ile | ja | 4,6 % | unpolar |
| Leucin | Leu | ja | 7,5 % | unpolar |
| Lysin | Lys | ja | 7,0 % | basisch |
| Methionin | Met | ja | 1,7 % | unpolar |
| Phenylalanin | Phe | ja | 3,5 % | unpolar |
| Prolin | Pro | nein | 4,6 % | unpolar |
| Serin | Ser | nein | 7,1 % | polar/neutral |
| Threonin | Thr | ja | 6,0 % | polar/neutral |
| Tryptophan | Trp | ja | 1,1 % | unpolar |
| Tyrosin | Tyr | nein | 3,5 % | polar/neutral |
| Valin | Val | ja | 6,9 % | unpolar |
Essentielle Aminosäuren
Folgende Aminosäuren gelten als für den Menschen als essentiell, d.h. sie müssen mit der Nahrung aufgenommen werden:
- Isoleucin
- Leucin
- Lysin
- Methionin
- Phenylalanin
- Threonin
- Tryptophan
- Valin
- Arginin (für Kinder und alte Menschen essentiell, sonst semi-essentiell)
- Histidin (für Kinder essentiell)
Semi-essentielle (auch bedingt essentielle oder halb essentielle) Aminosäuren können aus anderen essentiellen Aminosäuren umgewandelt werden, können aber in bestimmten Lebensabschnitten oder aufgrund von Erkrankungen zu essentiellen Aminosäuren werden.
Von der Aminosäure zum Eiweiss
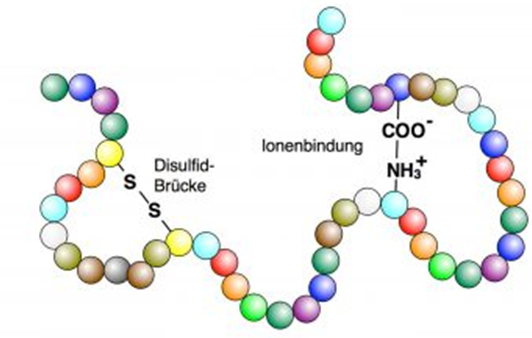 Primärstruktur
Primärstruktur
Eiweisse sind aus einer unverzweigten Kette von Aminosäuren aufgebaut. Eine Peptidbindung erfolgt zwischen der Carboxylgruppe und der Aminogruppe unter Wasserabspaltung. In der Abbildung links stellt jede farbige Kugel eine bestimmte Aminosäure dar. Diese Kette von Aminosäuren ist die Primärstruktur eines Eiweisses. Die Reihenfolge der Aminosäuren in der Kette wird von Genen bestimmt (siehe Genetik).
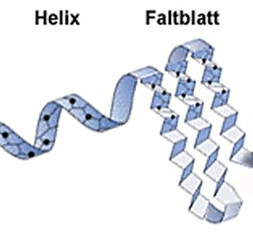 Sekundärstruktur: Helix und Faltblatt
Sekundärstruktur: Helix und Faltblatt
Durch Wasserstoffbrücken und Disulfidbrücken bilden sich in der „Perlenkette“ Strukturen, so die Helix (Schraube) und die Faltblattstruktur. Dies nennt man die Sekundärstruktur.
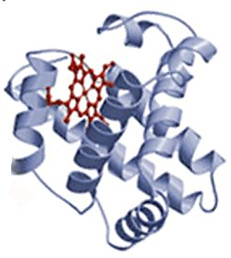 Die Tertiärstruktur
Die Tertiärstruktur
Diese Sekundärstrukturen legen sich nun zusammen zur oft kugeligen Tertiärstruktur.
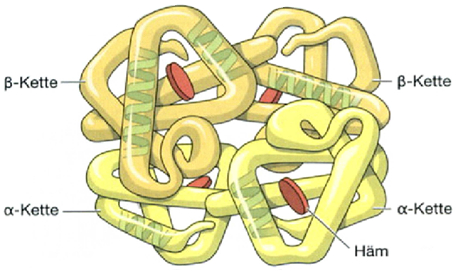 Quartärstruktur
Quartärstruktur
Bei bestimmten Eiweissen, wie dem Hämoglobin, legen sich Einheiten der Tertiärstruktur zusammen und bilden ein Protein mit Qartärstruktur. Hämoglobin besteht aus zwei α-Ketten und zwei β-Ketten.
Verschiedene Eiweisse
Grundsätzlich gibt es rundliche (globuläre) und faserige (fibrilläre) Eiweissmoleküle. Hier eine Zusammenstellung aus Wikipedia:
| Globuläre Proteine | Fibrilläre Proteine |
| Albumine | Kollagen |
| Globuline | Elastin |
| Histone | Keratin |
| Protamine | Fibrinogen |
| Prolamine | Myosin |
Eine bunte Zusammenstellung aus der Protein-Datenbank (PDB) finden wir hier. Zum Vergrössern aufs Bild klicken.
Denaturierung
Wenn sich der pH, Salzkonzentration oder die Temperatur ändern, kann sich das Protein entfalten und seine funktionierende Gestalt verlieren. Diesen Vorgang nennt man Denaturierung.
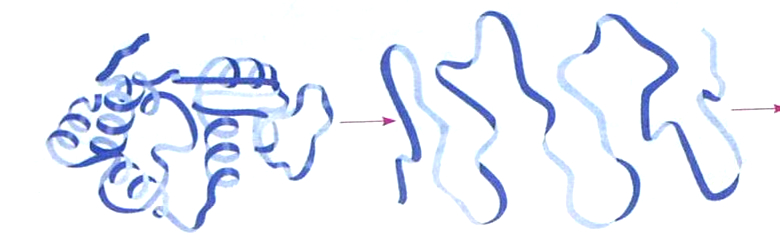
Durch den Verlust seiner Gestalt wird ein denaturiertes Protein biologisch unwirksam. Geschieht dies bei Enzymen, kann der Organismus gewisse Leistungen nicht mehr erfüllen. Daher ist zum Beispiel hohes Fieber für den Menschen gefährlich.
Beim Zubereiten von Spiegeleiern wird das Eiweiss weisslich und opak. Ebenfalls das Steak in der Pfanne. Das ist ein Beispiel für Denaturierung von Eiweissen.
Links zu Biomoleküle
- Grundstoffe des Lebens – Biomoleküle
- Kohlehydrate (Monosaccharide, Disaccharide und Polysaccharide)
- Proteine, Aminosäuren, Peptide
- Fette: Lipide, Phospholipide, Glycolipide, Sterole
- Nukleotide, Nukleinsäuren (wie DNS und RNS)
- Vitamine
- Hormone und Neurotransmitter