Der Begriff ATOM – ATOMOS kommt aus dem alten Griechenland
Bei den Vorsokratikern tauchte das Wort Atom zum ersten Mal auf. Es kommt von griechisch átomos, was „das Unteilbare“ oder „das Unzerschneidbare“ bedeutet.
Atom tönt auch ähnlich wie das Wort „Ana-tomie„: es bedeutet auseinander schneiden, zerlegen. Weiter kommt der Begriff „Mikro-tom“ auch von tomnein: schneiden.
 Demokrit (ca. 460 v.Chr. – ca. 356 v.Chr.)
Demokrit (ca. 460 v.Chr. – ca. 356 v.Chr.)
Dies war die Vorstellung des vorsokratischen Naturphilosophen Demokrit aus Griechenland: Etwa 450 v. Chr. folgerte er in Gedanken, dass es in der Materie es ein Teilchen geben muss, das nicht weiter geteilt werden kann.
„Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süss oder bitter; in Wirklichkeit gibt es nur Atome und leeren Raum.“ (Demokrit)
Nach Demokrit ist der Raum aufgeteilt in das Volle und das Leere. Sowohl das Vollen wie auch dem Leeren kommt Existenz und Sein zu. Die unteilbaren, winzig kleinen und für das Auge unsichtbaren Elemente des Kosmos sind die Atome. Atome unterscheiden sich nach Demokrit durch Gestalt und Grösse.
Von Natur aus sind diese unbewegt, Bewegungen entstehen erst durch An- und Abprallen der Atome untereinander, durch den „Schlag“, wie Demokrit sagt. Diese Bewegung der Atome ist ewig, aus ihr gehen sämtliche Erscheinungen in der Welt hervor. Es gibt keine Mischung der Substanz, sondern nur Verbindung und Trennung der Atome untereinander.
Aufgrund der unterschiedlichen Grösse haben die Atome eine unterschiedliche Schwere. Demokrit erklärt damit die Wesensart des Feuers, welches aufgrund der Leichtigkeit nach oben sich bewegt.
Unter den Atomen herrscht eine Wahlverwandtschaft: Gleiches gesellt sich zu Gleichem, wie beispielsweise die Atome des Meerwassers zueinander gefunden hätten.
Leukipp war der Lehrer von Demokrit und ihre Vorstellungen sind schwer von einander zu trennen bzw. sie genau dem einen oder anderen zuzuschreiben.
Diese atomistischen Ideen versanken nach der griechischen Kulturepoche fast vollständig (nur in der arabischen Wissenschaft wurden sie weiter erwähnt. Maimonides, Isidor von Sevilla). In der Neuzeit tauchten sie erst spekulativ durch bis sie erst in der Neuzeit wieder auftauchten.
John Dalton (1766 – 1844) und das Dalton-Modell
Der englische Lehrer John Dalton benutzte das Atomkonzept, um zu erklären, wieso Elemente immer in Mengenverhältnissen kleiner ganzer Zahlen miteinander reagieren (Gesetz der multiplen Proportionen). Er nahm an, dass jedes Element aus gleichartigen Atomen besteht und dass diese Atome sich miteinander verbinden und dadurch chemische Verbindungen bilden.
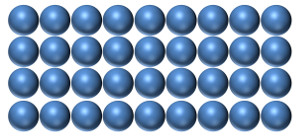
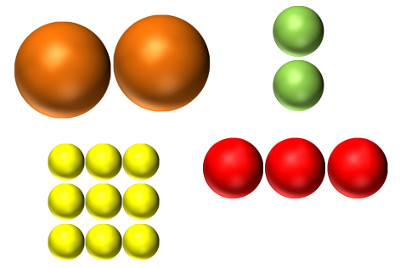
Ein Metall besteht aus gleichartigen kugelförmigen Atomen (links). Verschiedene Elemente haben verschieden grosse Atome (rechts).
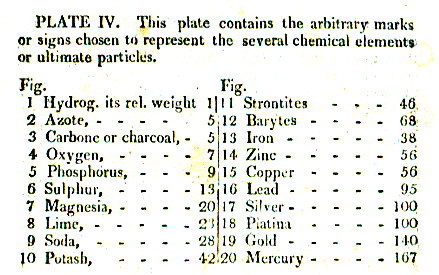
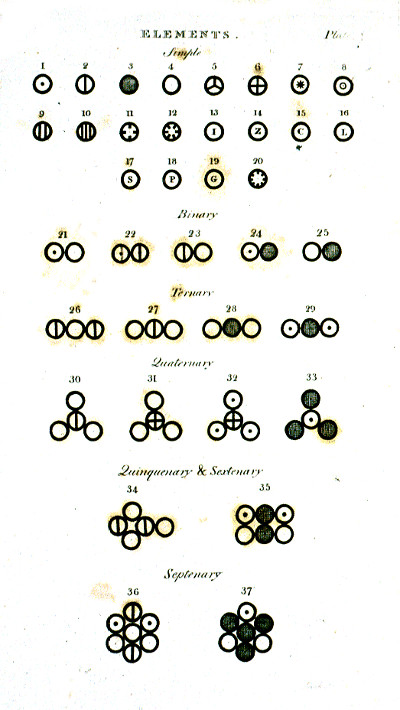
In Daltons Publikation sehen die Atome wie folgt aus:
John Thompson (1856 – 1940) und das Thompson-Modell
Joseph John Thomson entdeckte 1897 die negativen Ladungsträger der Atome, die Elektronen. Diese erwiesen sich als Bestandteil aller Materie, was dem Konzept des Atoms als unzerteilbarer Einheit widersprach. Thomson glaubte, dass die Elektronen dem Atom seine Masse verleihen und dass sie im Atom in einem masselosen positiv geladenen Medium verteilt seien wie „Rosinen in einem Kuchen“.
 |
Thompsons Atom-Modell
|
Ernest Rutherford (1871 – 1937), sein Versuch und was er daraus gelernt hat
Thompson hatte ein Atommodell vorgeschlagen, bei dem die gesamte Masse und die gesamte positive Ladung gleichmässig über das ganze Atom verteilt waren, während die Elektronen im Atom wie Rosinen in einem Kuchen eingebettet waren. Die gegenseitige Abstossung der Elektronen untereinander sorgte ebenfalls für ihre gleichmässige Verteilung über das Atom. Die sich ergebende, enge Verknüpfung zwischen den positiven und negativen Ladungen war vernünftig. Die Ionisation konnte durch das Herauslösen einiger Elektronen aus dem „Kuchen“ erklärt werden, wonach ein massives, festes Atom mit einem Überschuss an positiver Ladung zurückbleibt.
1910 widerlegte Ernest Rutherford (1871-1937) dieses Atommodell mehr oder weniger durch Zufall während einer Messung der Streuung von alpha-Strahlen an extrem dünnen Metallfolien.
Dabei benutzte er folgende Versuchsanordnung:
In einem Bleiblock befindet sich eine Quelle für alpha-Teilchen. Die Teilchen treffen auf eine sehr dünne Goldfolie (ca. 1000 Atomlagen dick). Rundherum stellt man einen Detektorschirm auf, um zu sehen, wohin die alpha-Teilchen abgelenkt werden.
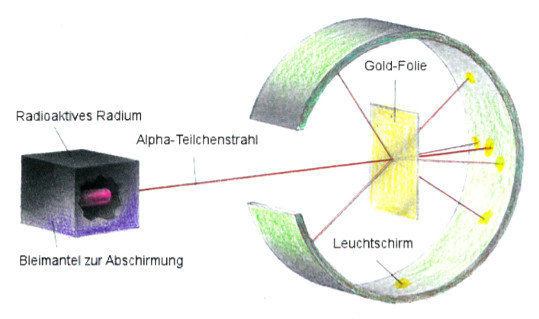
Für Rutherford war es erstaunlich, dass die Goldfolie Teilchen zurückwarf. Er hat angenommen, dass sie durch die Atome wie durch Pudding strahlen würden. Es war, als ob diese durch feste Widerstände zurückgeworfen werden konnten.
Schlussfolgerungen aus dem Experiment von Rutherford:
- Atome haben einen Durchmesser von ca. 10-10 m.
- Nahezu 99,9% der gesamten Masse ist im Atomkern mit einem Durchmesser von 10-14m konzentriert.
- Die gesamte positive Ladung befindet sich in Form von Protonen im Kern.
- Die negativen Ladungen befinden sich in Form von Elektronen im Raum um den Atomkern.
- Dieser Raum wird als Atomhülle bezeichnet.
- Die Elektronen umkreisen den Kern auf beliebigen Bahnen.
- Diese Bahnen bestimmen die Grösse des Atoms.
- Zwischen den Elektronen ist leerer Raum.
Das Kern-Hülle-Modell von Niels Bohr (1885 – 1962)
Das Atom besteht bei Niels Bohr aus dem Atomkern und der Atomhülle. Fast die gesamte Masse des Atoms ist im Kern konzentriert.
Der Atomkern besteht aus Protonen und Neutronen. Protonen sind einfach positiv geladen. Neutronen sind ungeladen (neutral). Die Atomhülle besteht aus kreisenden Elektronen, welche eine einfache negative Ladung tragen.
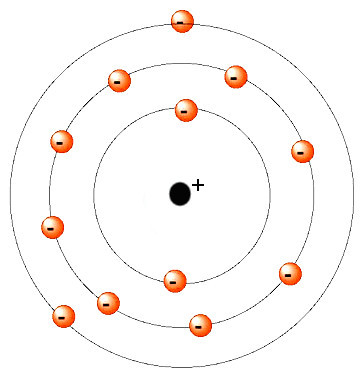
In Bohrs Modell gibt es sogenannte Schalen, auf denen sich die Elektronen bewegen. Nur die äussersten Elektronen, die sogenannten Valenzelektronen, sind an chemischen Reaktionen beteiligt.