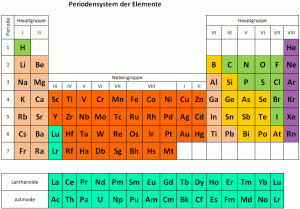
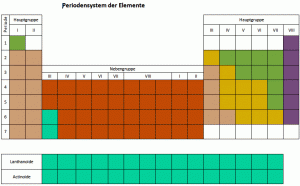
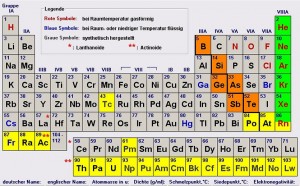
Die Elemente vom Periodensystem nach Eigenschaften gruppiert
Im letzten Jahrhundert wurden viele neue chemische Elemente entdeckt und anhand ihrer Eigenschaften in das Periodensystem der Elemente eingefügt. Im Periodensystem sind alle chemischen Elemente (mit Buchstabenkürzel, siehe Blatt) nach Ordnungszahl steigend geordnet, und es ergeben sich 8 Gruppen.
Bereits im 19. Jahrhundert entdeckten Chemiker, dass trotz der Verschiedenartigkeit der (damals bekannten) Elemente, diese auch gewisse Beziehungen und Ähnlichkeiten (in ihrem chemischen Verhalten) haben. Das Periodensystem selbst wurde 1869 unabhängig voneinander und fast identisch von zwei Chemikern aufgestellt, zunächst von dem Russen Dmitri Mendelejew (1834–1907) und wenige Monate später von dem Deutschen Lothar Meyer (1830–1895). Historisch war das Periodensystem für die Vorhersage der Entdeckung neuer Elemente und deren Eigenschaften von besonderer Bedeutung. Heute dient es vor allem der Übersicht.
Ähnlich reagierende Elemente
Mit dem Periodensystem konnten Elementgruppen aufgestellt werden, die sehr ähnlich reagieren. Beispielsweise sind Natrium, Lithium und Kalium (Alkalimetalle, 1. Gruppe) solch eine Gruppe, aber auch Chlor, Brom und Iod (Halogene, 7. Gruppe).
Die Eigenschaften der Elemente wiederholen sich in periodischer Weise, wenn man sie nach zunehmender Atommasse anordnete.
Nach Wasserstoff und Helium (einem Edelgas) kommt Lithium, ein typisches Metall. Dann folgen Elemente mit immer weniger ausgeprägtem Metallcharakter (Beryllium, Bor, Kohlenstoff), dann Nichtmetalle (Stickstoff, Fluor) und dann wieder ein Edelgas, das Neon.
Durch das Anordnen von Elementen mit ähnlichen Eigenschaften erstellte man 1870 das heute bekannte Periodensystem mit seinen 8 Gruppen.
Die acht Gruppen
Links im Periodensystem stehen die Metalle, es folgen Übergangselemente, dann typische Nichtmetalle. Die letzte Gruppe (8) sind die reaktionsträgen Edelgase.
Die Ladungszahl bestimmt Ordnungszahl und Platz.
Die Physik konnte wesentliche Erkenntnisse dazu beitragen, warum das Periodensystem genau so aussieht, wie es ist. Vor allem der von Ernest Rutherford entdeckte Atomkern ist wichtig. Dieser ist durch die Protonen positiv geladen und enthält fast die gesamte Masse eines Atoms. (Der Vollständigkeit halber sei noch eingefügt, dass der Atomkern auch noch neutrale Teilchen, die Neutronen, enthält, die für Chemiker prinzipiell weniger interessant sind.)
Entsprechend enthält die Aussenhülle des Atoms die gleiche Anzahl negativ geladener Elektronen.
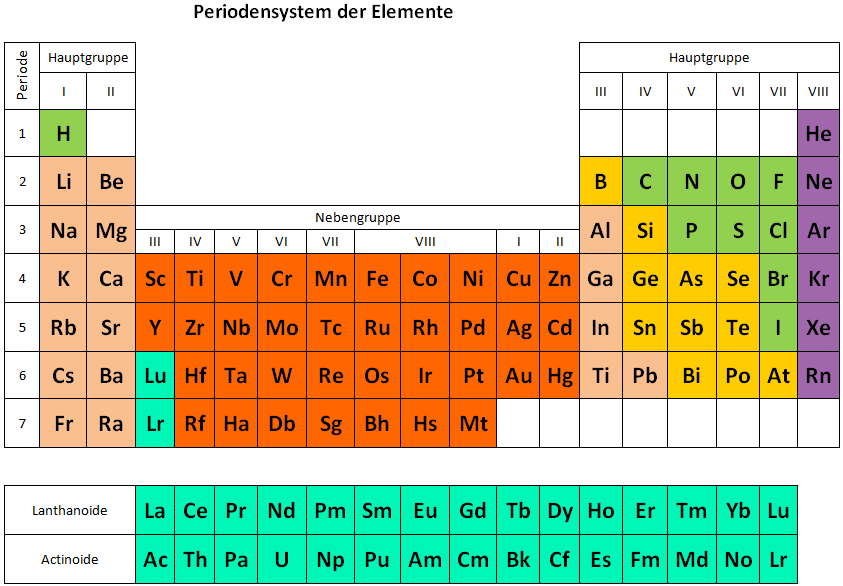
Die einzelnen Elemente unterscheiden sich anhand ihrer Atomkerne. Das leichteste Element, der Wasserstoff beispielsweise, hat in seiner einfachsten Form nur ein einziges Proton im Atomkern und ein Hüllenelektron. Wasserstoff hat daher die Ordnungszahl 1 im Periodensystem.
Helium hat zwei Protonen (und zwei Hüllenelektronen) und trägt die Ordnungszahl 2. Das System liesse sich beliebig fortsetzen: Stets bestimmt die Ladungszahl (also die Anzahl der Protonen im Kern oder die Anzahl der Elektronen) die Ordnungszahl im Periodensystem.
Dass zusätzlich zu dieser (physikalisch) bedingten Einordnung noch Gruppen entstehen, hängt mit dem Aufbau der Elektronenschalen in der Hülle zusammen: Die Aussenelektronen bestimmen nämlich das chemische Bindungsverhalten, das sich immer nach 8 Elektronen wiederholt, was einer vollen Elektronen-Schale entspricht.
Vorlagen (zum freien Gebrauch)
Alkalimetalle:
Lithium, Natrium, Kalium – Sie färben Flammen verschiedenfarbig.
Edelgase:
Helium, Neon, Argon, Krypton, Xenon, Radon, Ununoctium.
Elektronen:
Negativ geladenes Teilchen.
Elementfamilien:
Alkalimetalle, Alkalien, Erzbildner, Halogene / Salzbildner, Erdalkalimetalle, Bor-Aluminium-Familie, Nichtmetalle, Stickstofffamilie, Edelgase.
Erzbildner:
Sauerstoff, Schwefel, Selen.
Erdalkalimetalle:
Beryllium, Magnesium, Strontium, Calcium, Barium.
Halogene /Salzbildner:
Chlor, Brom, Iod, Fluor (Natriumchlorid).
Die Anordnung der chemischen Elemente nach bestimmten Regeln ist eine der wichtigsten tabellarischen Darstellungen in der Chemie. Diese Anordnung in tabellarischer Form wird auch Periodensystem der Elemente genannt. Es ist das wichtigste Werkzeug in der Chemie, wenn es darum geht, mit den Elementen zu arbeiten.
Die chemischen Elemente wurden nach steigender Ordnungszahl angeordnet. Sie bezeichnet gleichzeitig auch die Anzahl Protonen in einem Element. Diese Anordnung erfolgt in sieben waagrechten Reihen. Diese bezeichnet man auch als Perioden. Die acht senkrechten Spalten sind nach Gruppen geordnet. Die Ordnungszahl ist jedoch nicht nur eine reine Nummerierung, um eine übersichtliche Anordnung zu ermöglichen. Sie gibt ausserdem an, wie viele Protonen sich im Atomkern und wie viele Elektronen sich in einem Element befinden. Hier lohnt es sich, einen kurzen Blick auf den Aufbau eines Elements zu werfen.
Verschiedene Stoffe weisen ähnliche Eigenschaften auf und lassen sich in Gruppen einteilen. So gibt es die verschiedenen Familien der Elemente. Die Familien sind die folgenden:
Elementfamilien
Alkalimetalle
Alkalien
Erzbildner
Halogene / Salzbildner
Erdalkalimetalle
Bor-Aluminium-Familie
Nichtmetalle
Stickstofffamilie
Edelgase
Alkalimetalle:
Lithium, Natrium, Kalium – Sie färben Flammen verschiedenfarbig. Alkalien sind die Oxide der Alkalimetalle; sie bilden mit Wasser ätzende Laugen
Edelgase:
Die Edlen und Glücklichen (da sie durch ihre Elektronen gerade stabil und zufrieden sind) Helium, Neon, Argon, Krypton, Xenon, Radon, Ununoctium.
Erzbildner:
Sauerstoff, Schwefel, Selen
Erdalkalimetalle:
Beryllium, Magnesium, Strontium, Calcium, Barium
Halogene /Salzbildner:
Die Unglücklichen (da ihnen ein Elektron fehlt): Chlor, Brom, Iod, Fluor (Natriumchlorid)
Nichtmetalle:
Sauerstoff, Wasserstoff, Kohlenstoff, Stickstoff, Schwefel, Phosphor
Ordnungszahl:
Die Elemente im Periodensystem wurden angeordnet und ihnen wurden, je nach Platzierung, Zahlen zugeordnet. Diese Zahlen bezeichnet man als Ordnungszahlen.
Links
Hier ein gutes und sehr informatives Periodensystem.