Ionenbindung, Elektronenpaarbindung, Elektronegativität
Aus Atomen werden Stoffe, indem Atome sich verbinden. Die Eigenschaften der Atome bestimmen, welche Bindungen entstehen. Grundsätzlich gilt, dass an den chemischen Bindungen die Valenzelektronen beteiligt sind.
Die Ionenbindung
Jedes Atom strebt an, die Edelgaskonfiguration zu erreichen. Dies kann erreicht werden, wenn ein Atom ein oder mehrere Elektronen der Valenzschale abgibt oder aufnimmt.
Wenn z.B. das Natriumatom das einzelne Elektron auf seiner Valenzschale abgibt, wird es zum positiv geladenen Natrium-Ion, das eine Edelgaskonfiguration erhält.
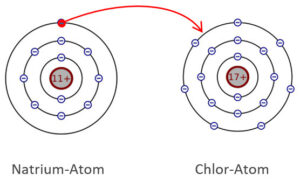
Ein Chlor-Atom ist sehnsüchtiger Abnehmer dieses Elektrons. Es wird dabei zum negativ geladenen Chlor-Ion Cl–.
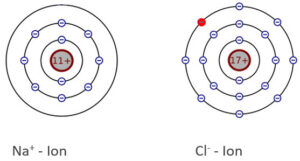
Durch ihre entgegengesetzte Ladung ziehen sich die beiden Ionen an. Zusammen mit anderen Na+ – und Cl- – Ionen bilden sie ein Ionen-Gitter.
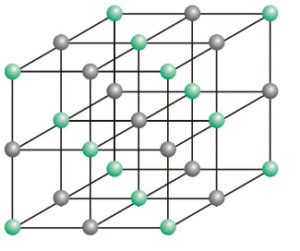

Ionen-Bindungen (Ionengitter) können von vielen Elementen gebildet werden. Oft sind Erdalkali- und Alkali-Metalle und Halogene oder Chalkogene dabei beteiligt.
Beispiel Magnesium-Oxid: Das Magnesium gibt 2 Elektronen ab, das Sauerstoffatom nimmt sie. Es entstehen zweifach geladene Ionen mit Edelgaskonfiguration.
Die Elektronenpaarbindung
Bei der Elektronenpaarbindung werden Elektronen nicht abgegeben/aufgenommen, zwei Atome teilen sich Elektronen und verwenden sie gleichsam gemeinsam, um zur Edelgaskonfiguration zu kommen.
Beispiel Sauerstoffatome:
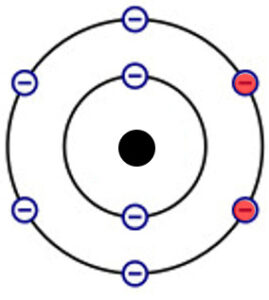
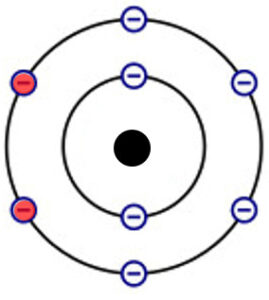
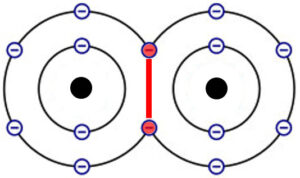
Die zwei Sauerstoffatome teilen sich je 2 Elektronen ihrer Valenzschale und erlangen somit beide die Elektronengaskonfiguration.